PCR實驗的污染來源都有:樣本間交叉污染、實驗試劑污染、擴增產物污染
防止實驗污染都有哪些措施?
對于低流行地區,PCR檢測人員經過嚴格培訓上崗后,核酸污染的風險相對較小,但在疫區超負荷工作時,就可能會遇到核酸污染的問題,可通過以下措施降低污染機會:
正確佩戴手套:手套未緊密貼合拇指、食指和中指,在進行開蓋操作時容易發生交叉污染。
正確使用生物安全柜:簡單、整潔、避免通風口堵塞;操作前后紫外線照射,消毒劑隨手可及;廢液缸里有1/3體積的含氯消毒液,并且及時清理廢液缸,保證廢物不超過廢液缸體積的2/3。
核酸提取儀去污染:每天多批次檢測時,在每一批次檢測完以后必須用75%的乙醇和核酸去除劑對儀器進行去污染。
重視通風:不定期對房間進行通風,每次至少持續30min。
PCR擴增區去污染:PCR反應管必須蓋緊,避免擴增后的核酸對環境的污染。
實驗室隨手可及的消毒劑。
常規PCR Kit (經典法)(不含Taq酶)
特點
1.內控對照為獨立包裝,遵循歐洲藥典和日本藥典操作流程。
2.高特異性,僅一條陽性對照條帶,即可涵蓋所有可能感染細胞的支原體物種。操作簡單,
易于觀察。
3. 高靈敏度,若PCR反應體系加入10μl樣本,支原體檢測限度為≤5或≤10CFU。
(詳見下文“(2)Venor® Gem Classic Kit 10種常見支原體檢測限“)
4.歐洲藥典要求的26種支原體均可檢出。該試劑盒可檢測出1種脲原體、7種無膽甾原體和85種支原體,與細菌和真核DNA無交叉反應。
5.試劑盒中不含Taq酶,可另外購買。推薦使用德國MB公司專用Taq酶。(貨號: 53-1050)
Venor® Gem Classic Kit
10種常見支原體檢測限

操作步驟
第1步:樣本處理
a. 細胞培養上清

b. 生物藥或需遵循藥典的樣本
說明:①樣品基質可能會影響檢測的靈敏度。收集和篩選更高的樣品量可提高測定靈敏度。
②細胞培養物樣本含豐富的DNA酶,在低溫下也能降解支原DNA,影響檢測靈敏度。
建議:樣本做DNA抽提處理,實現最高靈敏度。
推薦:德國MB公司生產的專用支原體DNA提取試劑盒,Venor® Gem Sample Preparation Kit。該DNA抽提試 劑盒已經過廣泛驗證。
第2步:試劑制備

第3步:PCR體系建立
a. 細胞培養上清
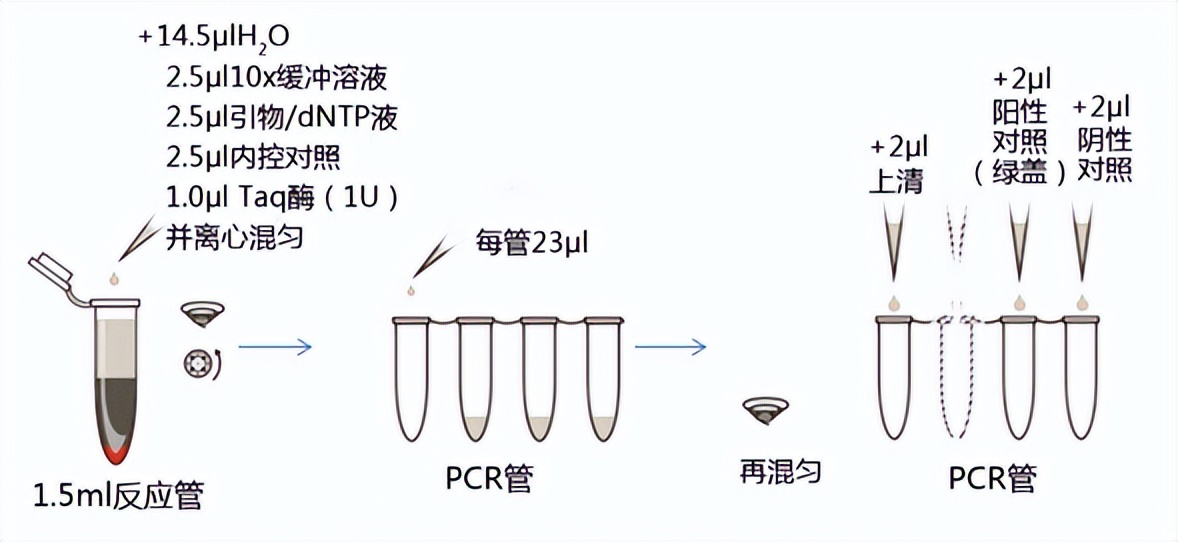
b. 生物藥或需遵循藥典的樣本

第4步:啟動PCR反應

第5步:電泳結果分析

191bp為內控對照條帶,表明PCR反應正常。
當樣本存在支原體污染時,由于內控對照與支原體DNA存在競爭,內控對照條帶變弱(例如支原體DNA>103拷貝)。
陽性對照中支原體DNA>104拷貝,內控對照條帶會*消失。
可能在80-90bp存在引物自退火形成的條帶,此條帶不影響檢測結果。
如果待測樣本對PCR產生抑制,則內控對照條帶變弱(和陰性對照相比),此時應先進行DNA抽提(推薦使用:Venor® Gem Sample Preparation Kit 支原體DNA抽提試劑盒,詳見第25頁),然后再檢測。

儲存條件
2~8℃至少6個月。復溶后在-18℃保存。

 400-166-8600
400-166-8600
 當前位置:
當前位置: